ES細胞・iPS細胞は、多能性維持と細胞分化という幹細胞特有の生理現象を解析するための格好のモデルです。我々の研究室では、これらの動的現象を、分子生物学、細胞生物学、ゲノム科学を駆使して解析しています。とりわけ、順遺伝学的なアプローチ(下記項目1参照)を中心に据えることで、研究者の想定の及ばない未知の遺伝子機能を積極的に探索しています。
1.ホモ変異体マウスES細胞株を用いた順遺伝学による多能性制御機構の解析
多数の遺伝子破壊株から目的の表現型を有す細胞株を同定する「順遺伝学」は、はじめに遺伝子機能を仮定しないため、研究者が予想もしなかった新規の遺伝子機能を明らかにできると期待できます。実際、大腸菌や酵母などのモデル生物では、順遺伝学によって数多くのブレークスルーがなされてきました。しかし、哺乳動物細胞では、遺伝子が2コピー存在するため、ホモ変異体を迅速に作製することが容易ではありません。そこで我々は、マウスES細胞において順遺伝学的解析を実現することを目指して、ホモ変異体を迅速に作製する技術を開発しました(Horie, Nature Methods 2011, 図1, 動画1)。この手法では、まず、レトロウイルスやトランスポゾンを変異原に用いてヘテロ変異体を作製します。次に、テトラサイクリンシステムを用いてBloom遺伝子を一過性に抑制することで、相同染色体間の組換えを誘発し、ヘテロ変異体からホモ変異体を誘導します。
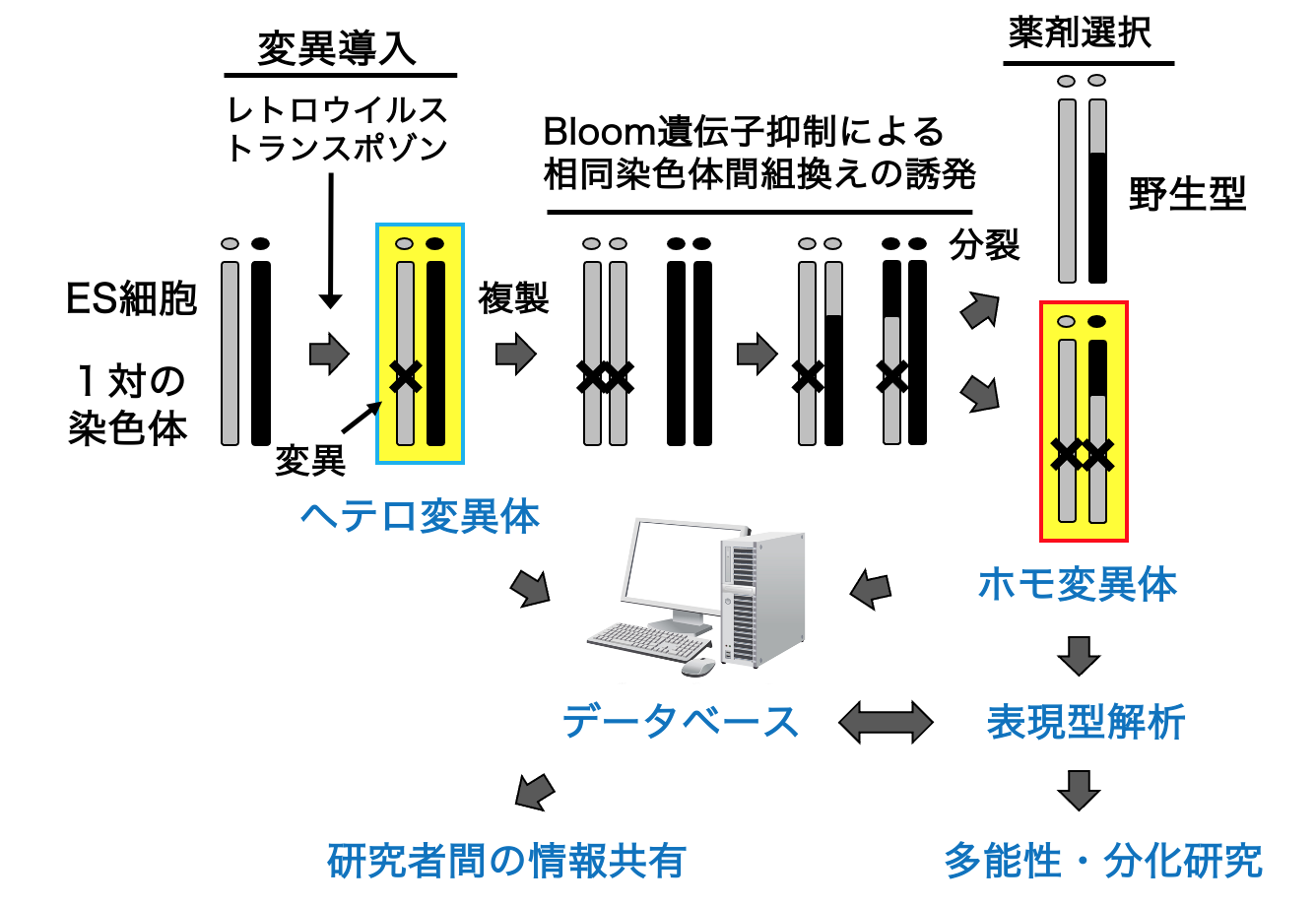
図1. ホモ変異体マウスES細胞の作製と応用

動画1. Bloom遺伝子の制御によるホモ変異体作出
我々はこれまでに、約2,000株のヘテロ変異体と約200株のホモ変異体ES細胞株を作製し、様々な表現型を示す遺伝子変異を同定してきました。多数の変異体を比較解析することで、ES細胞の多能性を包括的に理解することを試みており、多能性を制御する新規の経路も特定しています(Yoshida, Stem Cell Reports 2025; Kashiwagi, J Cell Sci 2024)。また、これらの変異体は、国際的なデータベースへも登録し(変異ES細胞バンクの項参照)、他の研究者にも利用されています(Nakai, Nat Commun 2024; Umemura, PLoS One 2013)。ゲノム改変効率を高めるべく、レトロウイルスやトランスポゾンのゲノム挿入機構の解析も行ってきました(Yoshida, Scientific Rep 2017)。さらに、近年進展の著しいCRISPR-Cas システムも取り入れ、メガベースに及ぶゲノム領域の欠失や(Miyata, DNA Res 2023)、精度の高いゲノム改変を行うための実験的プロトコールの検討(Higashitani, Scientific Rep 2023)なども行っています。
2.ES細胞の多能性の不均一性と動的変動状態の解析
近年の1細胞解析技術の進歩により、一見して均一に見える細胞にも不均一性が存在することが明らかになってきています。ES細胞の多能性も、個々の細胞で異なり、かつ、多能性の状態は動的に変動しています。ES細胞の不均一性と動的変動状態の理解は、生命現象の共通原理の理解に繋がるのみならず、ES/iPS細胞を効率的に再生医学へ応用するためにも重要なテーマです。我々は、マウスES細胞の多能性の変動状態を蛍光蛋白で可視化し、蛍光蛋白の発現を指標にしながら、ES細胞の多能性の制御機構の解析を進めています(動画2)。既知の変動状態のみならず、これまで知られていなかった新規の変動状態も、順遺伝学的な網羅的スクリーニングにより特定しており、そこから、多能性の未知の制御機構を解明しようと試みています。
動画2. マウスES細胞における多能性状態の変動
Green:Nanog-EGFP,Red:H2B-mCherry(Nucleus)
3.ヒトiPS細胞とゲノム科学を用いたヒト疾患の原因の解明
上記のマウスES細胞で培ったノウハウをヒトiPS細胞に適用し、ヒト疾患からのiPS細胞の樹立や、分化誘導による疾患モデル実験系の構築を進めています。その過程で、次世代シーケンサーを用いたRNA-seqや全ゲノム解読などの網羅的ゲノム解析も用いています。




